Фармакокинетика азитромицина и флуниксина в организме телят после однократного внутримышечного введения
Лобова П.С., кандидат ветеринарных наук, ведущий научный сотрудник, ФГБУ «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»), 123022, Москва, Звенигородское шоссе, 5;
Lobova P.S., PhD in biological sciences, leading research assistant, «The All-Russia State Center for Quality and Standardization of Veterinary Drugs and Feed», 123022, Moscow, Zvenigorodskoe highway, 5;
Енгашев С.В., доктор ветеринарных наук, профессор, генеральный директор «НВЦ Агроветзащита»,129329, Москва, Кольская ул., 1, стр. 1
Engashev S.V.,doctorofveterinaryscience, professor, general director «NVC Agrovetzaschita »
Абрамов В.Е.,доктор ветеринарных наук, профессор,
ведущий научный сотрудник, ФГБНУ «Всероссийский научно-исследовательский институт фундаментальной и прикладной паразитологии животных и растений имени К.И. Скрябина», 117218, г. Москва, ул. Б. Черемушкинская, 28
Abramov V.E.,doctor of veterinary science, professor, leading research assistant FSBSI «All-Russian Scientific Research Institute of Helminthology named after K.I. Skryabin», 117218, Moscow, B. Cheremushkinskaya 28
Кочетков П.П., заведующий испытательной лабораторией ООО «МНИЦ ОЗОС»,
117218, г. Москва, ул. Б. Черемушкинская, 28
Kochetkov P.P., нead of the testing laboratory of «MNIC OZOS»,
117218, Moscow, B. Cheremushkinskaya 28
Резюме
Изучена фармакокинетика азитромицина и флуниксина после однократного внутримышечного введения телятам в дозе 5 мг/кг по азитромицину и 2,2 мг/кг по флуниксину.Для определения азитромицина и флуниксина в сыворотке крови разработан и валидирован метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием. Предел количественного детектирования азитромицина 0,6 нг/мл, флуниксина1,8 нг/мл, степень извлечения азитромицина из сыворотки составила 97,8%, флуниксина – 95,4%; диапазон измеряемых концентраций 2,5-2500 нг/мл для двух компонентов.
Азитромицин быстро и хорошо всасывался из места инъекции. Максимальная концентрация антибиотика 817 нг/мл достигалась через 0,62 часа.Величина AUC составила 4815 нг/мл•ч, объем распределения - 467965 мл, что свидетельствует о быстром проникновенииантибиотика из кровяного русла в ткани. Учитывая спектр действия азитромицина и чувствительность к нему возбудителей респираторных инфекций, терапевтический уровень поддерживался на протяжении 2-3 суток в крови и значительно дольше – в тканях.
Противовоспалительный компонент флуниксин быстро всасывался из места инъекции, достигая максимальной концентрации 1323 нг/мл через 1 час.Величина AUC составила 5520,5 нг/мл•ч, объем распределения - 76323 мл, что говорит о преимущественном распределении в тканях. Значимые уровни флуниксина отмечались в течение 24 часов после введения, что свидетельствует о длительном противовоспалительном действии этого соединения. Однократная инъекция предложенной лекарственной формы обеспечивает необходимый терапевтический эффект на протяжении 48-72 часов.
Summary
Azithromycin and flunixin quickly and completely absorbed after single intramuscularinjection at a dose rate 5 mg/kg of azithromycin and 2.2 mg/kg of flunixin. HPLC-MC method was developed and validated for azithromycin and flunixin detection in serum. LOQ for azithromycin was 0,6ng/ml, for flunixinng/ml, extraction degree was 97,8% and 95,4% for azithromycin and flunixin respectively, linearity range was 2,5-2500 ng/ml for both compounds.
Azithromycin maximum values 817 ng/ml reached 0.62 hours post administration. AUC was4815 ng/ml•h, volume of distribution 467965 ml which indicates high degree of azithromycin penetration into tissues. In view of azithromycin spectrum of activity and sensitivity of most common pathogens of respiratory tract the therapeutic value is maintained for 2-3 days in blood and more longer – in tissues.
Anti-inflammatory agent flunixin quickly absorbed from the injection site, reaching maximum of 1323 ng/ml at 1 hour post dosing. AUC was 5520,5ng/ml•h, volume of distribution 76323 ml, which indicates the predominate distribution in tissues.Flunixin significant values were registered up to 24 hours post injection, which is evidenced of prolonged anti-inflammatory action of this compound. The single intramuscular injection provide therapeutic effect for 48-72 hours.
Ключевыеслова: азитромицин, флуниксин, фармакокинетика, телята.
Key words: аzithromycin, flunixin, pharmacokinetics, calves.
Введение
Анализ структуры заболеваемости телят в Российской Федерации показывает, что из года в год различные инфекционные болезни поражают более 70% животных; во многих хозяйствах страны по этой причине падеж составляет до 20% от общего числа поголовья. Обычно первичным этиологическим фактором инфекционного процесса являются вирусы, микоплазмы и хламидии, которые существенно ослабляют защитные силы организма и создают благоприятные условия для размножения бактерий. Вторичная бактериальная инфекция значительно осложняет течение заболевания и при отсутствии своевременного лечения приводит к гибели или потере продуктивности животного.
Для лечения таких ассоциированных инфекционных заболеваний необходимо использовать антибактериальные препараты, подавляющие не только патогенную микрофлору, но также активные в отношении внутриклеточных возбудителей, таких как микоплазмы и хламидии. В связи с этим важную роль играет способность антибактериального соединения проникать внутрь клетки, а также накапливаться в месте локализации патологического процесса.
В настоящее время наиболее широко для лечения заболеваний, вызванных микоплазмами и хламидиями, используются препараты группы макролидов (тиамулин, тилмикозин, тилозин) и фторхинолонов (энрофлоксацин,ципрофлоксацин).Однако постоянный рост резистентности среди возбудителей заставляет изыскивать новые эффективные лекарственные средства. В медицине для лечения респираторных инфекций бактериальной этиологии широко применяется азитромицин – полусинтетический антибиотик из группы азалидов, близких по химической структуре к макролидам и обладающих сходным спектром активности.На рынке ветеринарных препаратов антибактериальные средства на основе азитромицина только начинают появляться, таким образом, к этому соединению еще не успела сформироваться устойчивость у возбудителей инфекций. Согласно литературным данным у микроорганизмов обычно наблюдается перекрестная резистентность к эритромицину и азитромицину, однако ограниченное применение эритромицина для лечения бактериальных инфекций у животных позволяет сделать вывод о перспективности использования азитромицина в ветеринарной практике.
Азитромицин активен в отношении многих грамположительных и некоторых грамотрицательных аэробов – возбудителей респираторных заболеваний, таких как Streptococcusspp., Staphilococcusspp., Actinobacillusspp., Haemophilusspp. и Pasteurellamultocida. Но наиболее существенной является высокая активность азитромицина в отношении внутриклеточных возбудителей – микоплазм, хламидий, риккетсий.Немаловажную роль играет способность антибиотика накапливаться в нейтрофилах и оказывать положительное влияние на некоторые функции этих клеток, проявляя, таким образом, иммуномодулирующее действие. Уникальной особенностью азитромицина, в отличие от других макродидов, является то, что invitro он проявляет активность в отношении некоторых представителей семейства Enterobacteriaceae (кишечной палочки, шигелл, в меньшей степени – сальмонелл).
Благодаря высокой липофильности, азитромицинхорошо распределяется в организме, создавая во внутренних органах высокие концентрации, иногда в десятки раз превышающие сывороточные.Важной особенностью является тропизм азитромицинак очагу воспаления, а также его способность проникает внутрь клетки, что имеет большое значение при лечении микоплазмоза и хламидиоза.
Важную роль в патогенезе бактериальной инфекции играет воспалительный процесс, который осложняет течение заболевания и ухудшает состояние животного. Купирование воспалительной реакции может иметь большое значение для скорейшего выздоровления и сохранения продуктивности животного. Поэтому часто в комплексной терапии болезней бактериальной этиологии назначают нестероидные противовоспалительные средства, которые также обладают обезболивающим и жаропонижающим эффектом. Одним из таких соединений является флуниксин – неселективный ингибитор циклооксигеназ, играющих ведущую роль в развитии воспалительного процесса в очаге инфекции. Соединение в одной лекарственной форме антибактериального и противовоспалительного компонентов существенно облегчает проведение лечебных мероприятий (одна инъекция вместо нескольких) и снижает себестоимость лечения.
Целью данной работы было изучить фармакокинетикуазитромицина и флуниксина в сыворотке крови телят после однократного внутримышечного введения инъекционной лекарственной формы на сонове этих соединений в ориентировочной терапевтической дозе 5 мг/кг азитромицина и 2,2 мг/кг флуниксина.
Материалы и методы
Фармакокинетикуазитромицина и флуниксина изучали на 4телятахчерно-пестрой породы с массой тела 82-95 кг. Инъекционный раствор на основе азитромицина и флуниксина вводили однократно внутримышечно в дозе 1,0 мл на 20 кг массы животного, что соответствует 5 мг/кгазитромицина и 2.2 мг/кгфлуниксина. Кровь отбирали из яремной вены в полиэтиленовые пробирки без антикоагулянта, отделяли сыворотку и замораживали до момента исследования.Кровь для анализа брали до опыта (контрольные пробы) и через 3, 7, 10, 20, 30 минут; 1; 2; 3; 6; 9; 12; 24; 48; 72 и 96 часов после введения.
Концентрацию азитромицина и флуниксина в образцах сыворотки крови определяли методом ВЭЖХ-МС. Принцип метода заключается в хроматографировании на жидкостном хроматографе высокого давления с обращеннофазовой колонкой экстрактов сыворотки крови и детектировании при помощи масс-спектрометрического детектора в положительном режиме ионизации электроспрея. В качестве внутреннего стандарта использовали фенилпропиламин. Обработка полученных данных производилась с помощью программы «MassHunterWorkstationSoftware LC/MS DataAcquisitionTripleQuadrupoleVersion B.06.00».
Для построения калибровочных кривых использовали чистую сыворотку крови, в которую вносили растворы стандартных образцов азитромицина и флуниксинадля получения концентраций в сыворотке2.5; 25; 250 и 2500 нг/мл.
Азитромицин и флуниксин экстрагировали из сыворотки крови при помощи ацетонитрила, затем проводили твердофазную экстракцию на SPE-картриджах, очищенные экстракты анализировали методом ВЭЖХ-МС/МС при следующих параметрах:
Метод ионизации: электроспрей в положительном режиме (ESI+)
Температура ионизации: 300oC.
При исследовании распада ионовпод действием бомбардирующего потока молекул азота с последующим разрешением продуктов распада было установлено, что основные фрагменты азитромицина имеют массу 83, 158 и 116 – их использовали в дальнейшем для количественного определения по методу MRM (83) и качественного подтверждения принадлежности пика (158 и 116). Основные фрагменты флуниксина имели массу 279, 109 и 264: ион с массой 279 использовали для количественного определения, ионы с массой 109 и 264 – для качественного подтверждения принадлежности пика.
Хроматографирование экстрактов сыворотки проводили при следующих условиях: колонка хроматографическаяShodex ODP2 HP-2D (размер частиц сорбента – 5 µм), 150 х 2 мм; предколонкаShodex ODP2; подвижная фаза 0,05% раствор муравьиной кислоты в воде и 0,05% раствор муравьиной кислоты в ацетонитриле в соотношении 1:1; изократический режим; скорость подачи элюента 0,2 мл/мин; давление ~ 140 bar; объем вкола – 5 µл; температура термостата колонки 35 ˚C; температура термостата автосемплера 4 ˚C; продолжительность анализа – 5 минут.
При соблюдении вышеперечисленных условий время выхода пика азитромицина составило 1,3 минуты, флуниксина – 2,1 минуты, фенилпропиламина (внутренний стандарт) – 1,2 минуты.
Для определения степени экстракции и построения калибровочной кривой в сыворотку крови, полученную от телят до введения препарата, вносили точно известные концентрации стандартных растворовазитромицина и флуниксина.Конечные концентрации стандартов в сыворотке составили: 2,5; 25; 250 и 2500 нг/мл.
Подготовку проб сыворотки с внесенными стандартами и опытных образцов проводили по следующей методике: к 500 мкл сыворотки добавляли 500 мклацетонитрила и 250 мкл внутреннего стандарта (500 нг/мл), после чего образец перемешивали на вортексе в течение 3 минут, обрабатывали ультразвуком в течение 5 минут и далее центрифугировали в течение 10 минут при скорости 3000 g. Пробы очищали на SPE-картриджахEvolute ABN («Biotage», Швеция), которые предварительно последовательно промывали 1 мл метанола и 1 мл 0,1% водного раствора муравьиной кислоты со скоростью ~ 10 капель/мин. Супернатант наносили на подготовленный картридж со скоростью 1 капля/секунду. После нанесения картридж промывали 1 мл смеси метанол:вода в соотношении 5:95. Сорбированную на картридже пробу элюировали 500 мкл метанола. Элюат переносили в виалыавтосемплера и анализировали на хроматографе.
В процессе валидации разработанного метода были установлены его метрологические характеристики в соответствии с рекомендациями [1, 3].
Таблица 1. Метрологические характеристики метода определения азитромицина и флуниксина
|
Вещество |
LOD, нг/мл |
LOQ, нг/мл |
Калибровочная кривая, нг/мл |
Диапазон линейности, нг/мл |
Повторяемость (RSD), % |
Доверительный интервал (показатель точности), % |
|
Азитромицин |
0.5 |
0.6 |
y=0,0147x R > 0,99 |
2.5 – 2500 |
9 |
30 |
|
Флуниксин |
1.4 |
1.8 |
y=0,0036x R > 0,99 |
2.5 – 2500 |
7 |
22 |
Средняя степень извлечения азитромицина и флуниксина из сыворотки крови телят составила 97,8 и 95,4% соответственно.
Результаты исследования
Результаты исследования фармакокинетикиазитромицина в сыворотке крови телят показали, что максимальная концентрация азитромицина порядка 1000 нг/мл достигается через 0,5 часа после введения препарата.Максимальная концентрация флуниксина была обнаружена через 1 час после применения препарата и составила в среднем 1488 нг/мл, затем концентрация снижалась и через 96 часов составляла около 14 нг/мл (таблица 2).
Таблица 2. Концентрации азитромицина и флуниксина (средние значения по 4 животным±стандартное отклонение) в пробах сыворотки крови телят.
|
Время, ч
Вещество |
0 |
0,05 |
0,12 |
0,33 |
0,5 |
1 |
3 |
6 |
12 |
24 |
48 |
72 |
96 |
|
Флуниксин |
<LOQ |
270 |
419 |
823 |
1024 |
1488 |
641 |
372 |
99 |
37 |
16 |
13 |
14 |
|
SD |
- |
80 |
86 |
203 |
239 |
225 |
82 |
151 |
26 |
14 |
2 |
2 |
5 |
|
Азитромицин |
<LOQ |
149 |
323 |
856 |
1009 |
551 |
517 |
328 |
134 |
95 |
63 |
34 |
17 |
|
SD |
- |
59 |
135 |
92 |
143 |
24 |
54 |
27 |
18 |
8 |
3 |
2 |
2 |
Полученные экспериментальные данные были апроксимированы математически [2] с применением модели C = A* (e-αt + e-βt) и расчетом основных фармакокинетических параметров: периода полураспределения, периода полувыведения лекарственного вещества, констант всасывания и элиминации, времени достижения максимальной концентрации, величины максимальной концентрации, площади под кривой "концентрация лекарственного вещества – время" (таблица 3).
Таблица 3. Фармакокинетические параметры азитромицина и флуниксина после однократного внутримышечного введения телятам
|
Параметры |
Азитромицин |
Флуниксин |
|
K1, ч-1 |
5,84±1,43 |
2,25±1,31 |
|
Kel, ч-1 |
0,20±0,04 |
0,45±0,29 |
|
Cmax, нг/мл |
817.28±48,54 |
1323,03±153,21 |
|
AUC(0-T), нг/мл*ч |
4814.80±645,02 |
5520,49±950,54 |
|
AUMC(0-Inf), нг/мл*ч2 |
26776.63±8661,41 |
19993.55±8883,51 |
|
MRT, ч |
5.46±1,06 |
3.50±1,10 |
|
Tmax, ч |
0.62±0,14 |
1.00±0,17 |
|
T1/2, ч |
3.66±0,76 |
2.01±1,02 |
|
Vd, мл |
467965.00±36950,01 |
76323.30±58022,38 |
|
Cl, мл/ч |
90393.30±11666,35 |
22072.17±13504,44 |
Графически динамика изменения концентрации азитромицина и флуниксина в сыворотке крови телят представлена на рисунках 1 и 2.
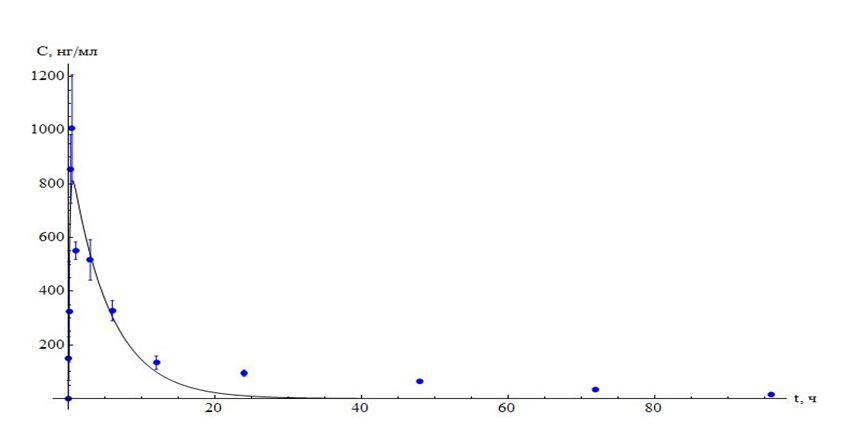
Рисунок 1. Динамика изменения концентрации азитромицина в сыворотке крови телят после однократного внутримышечного введения в дозе 5 мг/кг.
На рисунке 1 видно, что уровень азитромицина в крови резко нарастает, достигая максимума к 30 минутам, а затем также достаточно быстро снижается: концентрация аналита падает почти в 2 раза в течение 3 часов после введения. Дальнейшее снижение содержания антибиотика в сыворотке происходит очень плавно, и даже через 96 часов после инъекции в крови обнаруживаются уровни азитромицина, сопоставимые с МПК для некоторых чувствительных возбудителей (например, МПК азитромицина в отношении микоплазм составляет порядка 0,001-0,1 мкг/мл) [7].
Такое распределение в крови характерно для веществ, быстро проникающих из плазмы в ткани. Как известно, азитромицин является липофильным соединением; согласно литературным данным его концентрации в тканях в 10-200 раз превышают сывороточные[5,6].Азитромицин также в незначительной степени связывается с белками плазмы [3]: в зависимости от концентрации степень связывания с белками варьирует от 7% (при плазматическом уровне 1-2 мкг/мл) до 50% (при концентрациях ниже 0,1 мкг/мл). Данное свойство также способствует быстрому переходу вещества из крови в ткани [3].
Полученные в наших исследованиях экспериментальные данные и рассчитанные фармакокинетические параметры подтверждают это положение.Фармакокинетикаазитромицина характеризовалась достаточно высоким значением AUC (площади под фармакокинетической кривой) и очень большим уровнем кажущегося объема распределения(467965.00±36950,01 мл), что свидетельствует о накоплении аналита в тканях.
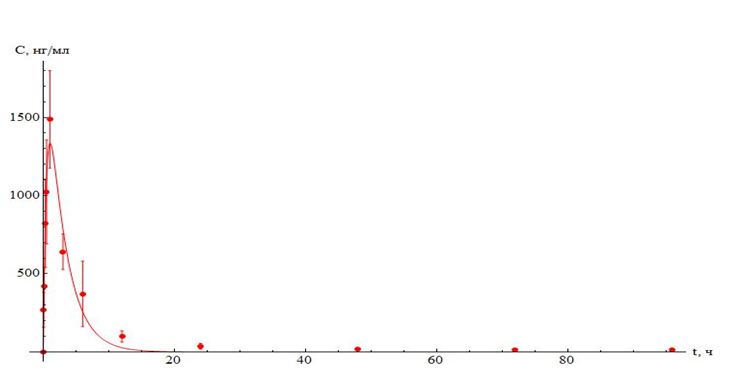
Рисунок 2. Динамика изменения концентрации флуниксина в сыворотке крови телят после однократного внутримышечного введения в дозе 2,2 мг/кг.
Второй компонент препарата – флуниксин – также быстро достигал максимума после однократного внутримышечного введения: уже через час его концентрация составляла порядка 1500 нг/мл. Далее следовало достаточно резкое снижение содержания флуниксина в крови: через 3 часа его уровень снизился более чем в 2 раза, а через 12 часов – более чем в 10 раз по сравнению с максимальной концентрацией. При анализе фармакокинетических параметров, рассчитанных для флуниксина, как и в случае с азитромицином, обращают на себя внимание большие значения площади под кривой (AUC) и объема распределения; очевидно, что флуниксин в данном случае также достаточно быстро переходит из сосудистого русла в ткани, что существенно для купирования воспалительного процесса.
Параметры, характеризующие элиминацию вещества из организма (клиренс, период полувыведения, MRT) показали, что азитромицин и флуниксин достаточно быстро выводятся из системного кровотока. Согласно многим литературным данным для азитромицина характерен длительный период полувыведения, 14-35 часов согласно разным источникам [6,8,9]. В наших исследованиях период полувыведения оказался короче –3,66 ч, однако здесь необходимо иметь в виду, что значение рассчитывалось для сыворотки крови.
Заключение
На основании полученных нами результатов и литературных данных можно сделать вывод, что эффективные терапевтические концентрации азитромицина и флуниксинапосле внутримышечного введения быстро достигаются и поддерживаются продолжительное время (до 3 суток). Принимая во внимание способность азитромицина накапливаться в тканях в значительно более высоких концентрациях, чем в сыворотке, можно сделать вывод, что даже однократной инъекции препарата будет достаточно для обеспечения терапевтического эффекта в течение нескольких суток. Трехкратное введение препарата создаст необходимые условия для подавления возбудителя в очаге инфекции за счет антибактериального компонента и будет способствовать скорейшему восстановлению тканей благодаря противовоспалительномудействию флуниксина.
Список использованной литературы
1.РМГ 76-2004 «ГСИ. Внутренний контроль качества результатов количественного химического анализа».
2. Варфоломеев С.Д. и Гуревич К.Г. - «Биокинетика» Практический курс // Москва, 1999 г., с. 720.
3. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике, 2007. Болезни органов дыхания. 2012. № 1. с.14-22.
4. Эпштейн Н. А. Оценка пригодности (валидация) ВЭЖХ методик в фармацевтическом анализе (обзор) // Химико-фармацевтический журнал. 2004. Том 38. № 4. С. 48-56.
5. Bergan T. Pharmacokinetics of newer macrolides. In: New Macrolides, Azalides, and Streptogramins in Clinical Practice. Neu HC, Young LS, Zinner SH, Acar JF. (eds.). New York, etc., 1995; р. 51-60.
6. BibhutiRanjan, Vinod Kumar Dumka, Ajay Kumar Ola, «Pharmacokinetics, Urinary Excretion and Plasma Protein Binding of Azithromycin in Water Buffalo (Bubalusbubalis L.) Calves». 2012;р. 468-482.
7. GialdroniGrassi G, Grassi C. Clinical application of macrolides and azalides in Legionella, Mycoplasma, and Chlamydia respiratory infections. In: New Macrolides, Azalides, and Streptogramins in Clinical Practice. 1995; р. 147-54.
8. Hopkins S.J. Clinical Toleration and Safety of Azithromycin in Adults and Children // Rev. Contemp. Pharmacother. 1994. V. 5. р. 383–389.
9. Hunter R.P, Lynch M.J, Ericson J.F, et al. Pharmacokinetics, oral bioavailability and tissue distribution of azithromycin in cats. J Vet PharmacolTher 1995; 18: 38-46.